Pengertian rumus empiris dan molekul adalah ulasan tentang jenis rumus kimia yang dibedakan berdasarkan jumlah unsur-unsur atom penyusunnya. Suatu rumus kimia dari suatu senyawa dapat tersusun atas unsur-unsur atom yang sama namun memiliki jumlah molekul yang berbeda. Contohnya adalah CH3 (metil) dan C2H6 (etana), di mana keduanya sama-sama disusun oleh atom karbon karbon (C) dan Hidrogen (H). Pada senyawa CH3 terdapat satu buah atom karon dan tiga atom hidrogen. Sedangkan senyawa C2H6 memiliki dua atom karbon (C) dan 6 atom hidrogen (H). Senyawa CH3 dan C2H6 merupakan rumus kimia denga jenis yang berbeda. Senyawa CH3 merupakan rumus empiris, sedangkan senyawa C2H6 merupakan rumus molekul.
Apa yang dimaksud rumus empiris? Apa itu rumus molekul? Sobat idschool dapat mencari tahu lebih banyak melalui ulasan di bawah.
Rumus Empiris
Rumus empiris menunjukkan perbandingan atom-atom penyusun molekul degan perbaningan bilangan bulat paling sederhana. Cara mendapatkan rumus empiris dilakukan dengan mencari perbandingan mol terkecil dari atom-atom penyusun senyawa. Dari perbandingan mol dapat diperoleh perbandingan bilangan bulat terkecil yang mewakili perbandingan unsur atom dalam senyawa.
Sebagai contoh suatu senyawa memiliki hasil akhir perbandingan terkecil untuk atom C : H : O = 1 : 2 : 1. Dari perbandingan tersebut dapat disimpulkan bahwa senyawa tersusun atas satu atom C, dua atom H, dan satu atom O. Dengan demikian, diperoleh rumus empiris dari senyawa tersebut adalah CH2O (metanal/formaldehid).
Asal rumus empiris diperoleh berdasarkan suatu percobaan. Pemanfaatan rumus empiris untuk menunjukkan rumus molekul apabila tidak ada informasi tentang massa molekul relatif (Mr) dari suatu senyawa. Jika diketahui massa molekul relatifnya maka senyawa tersebut mempunyai rumus molekul.
Cara untuk menentukan rumus empiris dapat dilakukan melalui tiga langkah. Uraian ketiga langkah mencari rumus empiris diberikan seperti langkah-langkah berikut.
Langkah-langkah menentukan rumus empiris:
- Mencari perbandingan massa atau persentase unsur-unsur penyusun senyawa.
- Mencari perbandingan mol.
- Perbandingan mol yang paling sederhana menghasilkan rumus empiris.
Perhatikan soal dan cara menentukan rumus empiris berikut!
Soal: Diketahui persentase unsur C = 41,82%, unsur H = 6,51%, dan unsur O = 51,67%. Tentukan rumus empiris yang dibentuk unsur-unsur atom tersebut!
Jawab:
Misalkan massa senyawa sebesar 100 gram, maka massa atom karbon (C), hidrogen (H), dan oksigen (O) menjadi seperti berikut.
- C = 41,82 gram
- H = 6,51 gram
- O = 51,67 gram
Mencari perbandingan mol:
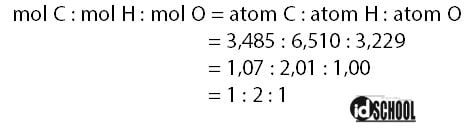
Perbandingan paling sederhana diperoleh C : H : O = 1 : 2 : 1. Jadi, rumus empiris yang dibentuk oleh unsur-unsur tersebut adalah CH2O.
Baca Juga: Rumus Kimia dari Suatu Senyawa
Rumus Molekul
Rumus molekul merupakan jenis rumus kinia yang menjadi rumus sebenarnya dari suatu senyawa. Dalam rumus molekul terdapat perbandingan yang sebenarnya dari unsur-unsur penyusun senyawa, Contoh beberapa rumus molekul adalah CH3COOH (rumus empiris: CH2O, n = 2), C6H12O6 (rumus empiris: CH2O, n = 6), C2H6 (rumus empiris: CH3), dan lain sebagainya. Beberapa senyawa memiliki rumus molekul sama dengan rumus empirisnya seperti H2O (air), CH4 (metana), CO2 (karbon dioksida), dan lainnya.
Pada bahasan sebelumnya, disebutkan bahwa rumus empiris digunakan saat tidak diketahui massa molekul relatif. Jika massa molekul relatif diketahui maka rumus empiris memiliki rumus molekul. Rumus empiris dan molekul memiliki hubungan yang dinyatakan dalam suatu persamaan. Persamaan tersebut menyatakan banyaknya mol rumus molekul suatu senyawa sama dengan n banyak mol pada rumus empiris. Di mana n merupakan suatu bilangan bulat.
Keterangan:
- Mr = massa molekul relatif
- n = suatu bilangan bulat
Langkah-langkah menentukan rumus molekul:
- Mencari perbandingan massa atau persentase unsur-unsur penyusun senyawa
- Mencari perbandingan mol
- Menentukan rumus empiris
- Mencari nilai n melalui persamaan n × Mr Rumus Empiris = Mr Rumus Molekul
- Menentukan rumus molekul
Perhatikan soal dan cara menentukan rumus molekul berikut!
Soal: Suatu senyawa mempunyai rumus empiris CH2O mempunyai Mr = 60. Tentukan rumus molekul senyawa tersebut! (Ar C =12, H = 1, O = 16)
Jawab:
Menentukan nila n:
Mr (CH2O)n = 60
(Ar C + 2 Ar H + Ar O)n = 60(12 + 2×1 + 16)n = 60
30n = 60
n = 60/30 = 2
Jadi, diperoleh rumus molekul untuk senyawa tersebut adalah (CH2O)2 = C2H4O2
Baca Juga: Hukum Perbandingan Volume – Gay Lusaac
Contoh Soal dan Pembahasan Rumus Empiris dan Molekul
Dua bahasan di atas memberikan contoh soal sederhana cara menentukan rumus empiris dan moleku. Sobat idschool dapat menambah pemahaman materi rumus empiris dan molekul melalui beberapa contoh soal yang lebih beragam di bawah. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal.
Contoh 1 – Soal Menentukan Rumus Empiris
Kelompok rumus kimia berikut yang semuanya merupakan rumus empiris adalah ….
A. NO2, H2O2, SO2
B. C2H2, C2H4, H2O2
C. C6H6, CH4, C2H4
D. H2O, H2O2, CO2
E. CH3, C2H6O, C2H5
Pembahasan:
Rumus kimia terdiri dari dua jenis yaitu rumus empiris dan rumus molekul. Rumus empiris memiliki karakteristik perbandingan mol paling sederhana untuk setiap unsur-unsur penyusun atomnya. Sedangkan rumus molekul memiliki perbandingan yang merupakan kelipatan dari rumus empirisnya.
Kelompok rumus kimia berikut yang semuanya merupakan rumus empiris terdapat pada daftar CH3, C2H6O, C2H5.
Jawaban: E
Contoh 2 – Soal Menentukan Rumus Molekul

Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh keterangan seperti berikut.
- Massa: Na2SO4 · xH2O = 23,2 gr
- Na2SO4 = 14,2 gr
Berdasarkan hukum kekelan massa (massa zat sebelum dan sesudah reaksi adalah sama) dapat diperoleh massa xH2O setelah reaksi.
massa xH2O setelah reaksi = 23,2 – 14,2 = 9 gram
Menghitung perbandingan mol Na2SO4 dan H2O:
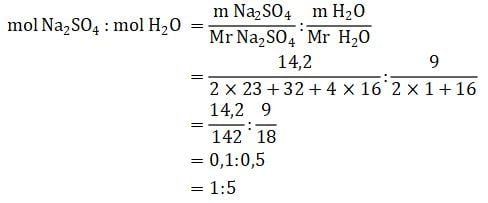
Jadi, rumus molekul senyawa hidrat tersebut adalah Na2SO4 · 5H2O
Jawaban: D
Contoh 3 – Soal Rumus Empiris dan Molekul
Suatu hidrokarbon mempunyai rumus empiris CH2. Jika Mr senyawa tersebut adalah 28 maka rumus molekulnya adalah …. (Ar C = 12, H = 1)
A. CH2
B. C2H2
C. C2H4
D. C2H6
E. C3H3
Pembahasan:
Menentukan nilai n:
n × Mr CH2 = 28
n × (Ar C + 2 × Ar H) = 28
(12 + 2 × 1)n = 28
14n = 28
n = 28/14 = 2
Mencari rumus molekul: (CH2)n = (CH2)2 = C2H4
Jadi, jika Mr senyawa tersebut adalah 28 maka rumus molekulnya adalah C2H4.
Jawaban: C
Demikianlah tadi ulasan materi pengertian rumus empiris dan molekul disertai dengan contoh soal menentukan rumus empiris dan rumus molekul. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Senyawa Hidrokarbon – Alkana, Alkena, dan Alkuna
Sumber gini.com


EmoticonEmoticon